En dråbe vand
Indledning
Vand er det mest almindelige stof på Jordens overflade. Uden vand kunne der ikke være noget liv. Din krop består af ca. 70% vand. Se på billedet herunder - Vand forekommer i 3 former:
- Fast form (is)
- Flydende form (vand) og
- Gasform (vanddamp)
Vandets form kan ændres, når det opvarmes eller afkøles (eller ved at ændre på trykket)
Hvordan ændres vandets form?
Når is varmes forsigtigt op, begynder den at smelte og bliver flydende. Hvis du fortsætter med at varme op, bliver isen til luft ved omkring 100° Celsius.
Hvorfor sker det?
Vand er et molekyle med den kemiske formel H2O, dvs. der er to brintatomer og et iltatom.
Partiklerne i den faste is er tæt pakkede og bundet sammen af kemiske bindinger, der kaldes hydrogenbindinger. De vibrerer hele tiden. Når du varmer isen op, får energien vibrationerne til at blive større. Nogle af bindingerne brydes, så partiklerne frit kan bevæge sig lidt rundt - og når det sker, bliver isen flydende. Når der tilføres mere varme, får partiklerne nok energi til at bryde alle deres bindinger og forsvinde som luft eller damp.
Den fysiske egenskab

Den fysiske egenskab ved et stof, som beskriver, hvor tætpakket de enkelte partikler er i stoffet, kaldes massefylde. Massefylde er et mål for mængden af materiale (masse eller m) på en given plads (volumen eller V), og den udtrykkes som forholdet:
Massefylde = m/V.
Forskellen i Jordens stoffers massefylde er det, der driver havstrømmene, vinden og forandringerne i jordpladerne. Normalt øges et stofs massefylde, når det skifter fra gasform til flydende form, og igen når det skifter fra flydende form til fast form. Massefylden øges også, når temperaturen falder, fordi den lavere temperatur giver mindre vibration af atomerne. Når atomerne ikke bevæger sig så meget rundt, bliver de mere tætpakkede. Men det er anderledes med vand! Vand har nogle meget usædvanlige fysiske og kemiske egenskaber, der gør det til et af de vigtigste stoffer på vores planet.
Se videoen, hvor ESA-astronaut Frank De Winne viser, hvordan vand opfører sig i vægtløs tilstand på den internationale rumstation. Undervisere kan anvende dette klip sammen med undervisningsnoterne herunder til at give eleverne mulighed for at sammenligne vands opførsel på Jorden og i rummet.
1. Solid water – how unusual is this solid!
Hvorfor er fast vand (is) usædvanligt?
Du forventer sandsynligvis, at et fast stof som is vil synke. Men du ved godt, at når du kommer isterninger i et glas med vand, så flyder de ovenpå.
Fyld en plastflaske med vand, og sæt proppen i. Kom flasken i fryseren, og se, hvordan den ser ud dagen efter. Proppen er måske blevet skubbet ud, og flasken ser ud, som om den har udvidet sig.
Vandets faste form (is) har en MINDRE massefylde end den flydende form. Massefylden af rent vand på fire grader Celsius er 1,0g/cm3, mens massefylden af is ved nul grader Celsius kun er 0,92 g/cm3. Flydende vand og is har forskellig massefylde, fordi molekylerne i isen befinder sig længere fra hinanden. Derfor optager molekylerne mere plads i is end i flydende vand.
I rummet: Frank tager en lille klump is og kommer den ind i en dråbe vand. Hvad sker der med isen inden i vanddråben? Flyder den, eller synker den eller noget helt tredje?
Svar: På den internationale rumstation er alt i FRIT FALD, og der er tilsyneladende ingen TYNGDEKRAFT. Tyngdekraften er den, der gør, at vi ikke svæver væk her på Jorden. Hvis du kaster noget, vil det altid lande på jorden til sidst. Av!
Denne tiltrækning af alting ned mod jordoverfladen kaldes tyngdekraft. Så alting vil svæve rundt på ISS ligesom astronauterne (og alt andet der ikke er bundet godt fast!). Selv vand. Isen vil hverken flyde ovenpå eller synke, men ganske enkelt bevæge sig rundt i vanddråben.
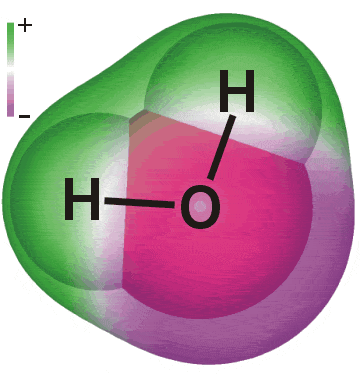
2. Vands polaritet
Vand er et polært molekyle.Vand har den kemiske formel H2O, der er to brintatomer bundet til et iltatom.
Et vandmolekyle har ingen generel ladning. Der er derimod en svag negativ ladning omkring iltatomet og en svag positiv ladning omkring brintatomerne. Dette kaldes en dipol. Vandmolekylets generelle ladning er nul. Den positive og den negative ladning er ens, og derfor ophæver de hinanden.
Forsøg: Demonstration af vandets dipolære karakter
Materialer:
- Udfør forsøget i nærheden af en vandkilde (for eksempel en vandhane)
- En glasstang eller en plastlineal
Metode:
- Lad vandet løbe ud af hanen i en tynd stråle.
- Tag linealen eller glasstangen, og placér den tæt på vandstrålen. Sker der noget?
- Gnid nu linealen eller stangen flere gange med en klud eller i en T-shirt. Bring den tæt på vandet. Hvad sker der nu? Hvorfor tror du, det sker?
På den internationale rumstation bruger Frank De Winne et stykke plastic (i stedet for en stang) for at skabe ladning (f.eks. positiv (+) ladning). Når han gnider plasticstykket mod sit tøj, dannes der en positiv ladning på overfladen. Når han placerer plasticstykket nærmere ved vanddråben, vil ladningen i plasticstykket tiltrække den modsatte ladning i vandmolekylerne (den negative ladning fra ilten). Tænk over dette spørgsmål. Hvorfor kan Frank ikke have en vandstråle på ISS? Hvad sker der med vanddråben, når han nærmer plasticstykket til den?
Svar:
Stangen eller linealen vil tiltrække vandstrålen, fordi der er en positiv ladning på stangen. Den positive ladning tiltrækker den negative ladning i vandmolekylet. Når Frank bringer plasticstykket tæt på dråben og flytter det ladede plasticstykke omkring den, følger dråben efter plasticstykket. Den negativt ladede ilt bliver tiltrukket af den positive ladning på plasticstykket.
Frank kan ikke bruge en vandstråle på ISS, fordi alting svæver rundt (er i frit fald), og vandet kan let trænge ind i elektrisk udstyr og gøre skade. Vandet skal komme fra en særlig drikkevandspose, og det skal tørres op bagefter.
3. Vands opløselighed

Vand har en meget vigtig egenskab, og det er evnen til at opløse mange faste og gasformige stoffer. Hvad sker der, når man kommer sukker (et fast stof) i kaffe?
Sukker er et såkaldt vandopløseligt stof. Nogle ting er uopløselige (kan ikke opløses). Kan du komme i tanke om nogle?
Vand er gennemsigtigt, så når noget opløses i det, kan vandet ændre farve.
Forsøg: Hvad opløses?
Materialer:
sukkerknald, saltkorn, pulverkaffe og kaffegrums, små stumper træ (savsmuld, hø), små spåner af plastic, stearinspåner, glaskrukker, ske eller rørepind, en vandkilde og noget til at kassere det brugte vand i.
Metode:
- Kom forskellige materialer i en krukke, et ad gangen, og se, om stoffet opløses eller ej. Du skal måske røre rundt.
- Lav en tabel over, hvad der opløses, og hvad der ikke gør.
På Jorden er det let at se, om noget opløses, især hvis det har en farve. Det ser ud som om, det ‘forsvinder’ i vandet. Når vi kommer sukker i te/kaffe, smager det sødt. (SMAG ALDRIG PÅ NOGET i klasseværelset!).
I rummet, hvor forholdene er anderledes end på Jorden? Vi ved, at alt svæver, men ville sukkeret bare svæve rundt i vandet, eller vil det faktisk blive opløst?
Frank prøver at opløse sukker i sin tebeholder. Hvad tror du, der ville ske, hvis vandet var varmere? Eller der blev rørt rundt i det? Astronauter får særlige poser, der indeholder både te og sukker. De skal komme varmt vand i posen og ryste den for at opløse sukkeret og blande det med teen. Hvordan kan Frank finde ud af, om der er sukker i hans te?
Svar:
Frank smager på teen, og den er sød, så sukker opløses faktisk i vand ude i rummet.




